Источник:
Клиническая фармакология по Гудману и Гилману, том 4.
Редактор: профессор А.Г. Гилман Изд.: Практика, 2006 год.
Действие на клетки
Инсулин обладает целым спектром биологических эффектов. Его главными мишенями служат печень, мышцы и жировая ткань, играющие ведущую роль в обмене глюкозы, однако инсулин влияет и на многие другие ткани. Это важнейший гормон, ответственный за транспорт, метаболизм и запасание клетками питательных веществ: он стимулирует анаболические процессы (утилизацию и запасание глюкозы, аминокислот и жирных кислот) и тормозит катаболические (распад гликогена, жиров и белков). Под действием инсулина стимулируется транспорт питательных веществ и ионов внутрь клетки, ускоряется внутриклеточное перемещение белков, активируются или инактивируются ферменты, изменяется количество белков путем изменения скорости транскрипции их генов и трансляции мРНК (рис. 61.3,61.4).
Некоторые эффекты инсулина проявляются в течение нескольких секунд или минут; среди них — стимуляция транспорта глюкозы и ионов, фосфорилирование и де-фосфорилирование ферментов, и даже ингибирование транскрипции гена фосфоенолпируваткарбоксикиназы (Granner, 1987; O’Brien and Granner, 1996). Для достижения других эффектов инсулина, в частности для изменения транскрипции большинства генов и изменения синтеза белка, требуется несколько часов. Эффект инсулина на пролиферацию и дифференцировку клеток проявляется только через несколько суток. Не ясно, обусловлены ли эти временные различия разными механизмами внутриклеточной передачи сигнала или разной кинетикой самих процессов, регулируемых инсулином.
Регуляция транспорта глюкозы
Важнейший физиологический эффект инсулина — стимуляция транспорта глюкозы в мышцах и жировой ткани. Глюкоза проникает в клетки путем облегченной диффузии, которая опосредуется специальными белками — переносчиками глюкозы. Известны пять таких белков (GLUT1, GLUT2, GLUT3, GLUT4 и GLUT5); считается, что они осуществляют независимый транспорт глюкозы в клетки путем облегченной диффузии (Shepherd and Kahn, 1999). Белки — переносчики глюкозы представляют собой гликопротеиды с молекулярной массой около SO ООО; каждый из них имеет по 12 трансмембранных а-спиральных доменов. Стимуляция инсулином транспорта глюкозы, по крайней мере отчасти, обусловлена энергозависимым перемещением внутриклеточных везикул, содержащих белки GLUT4hGLUTI, к клеточной мембране (Suzuki and Копо, 1980; Simpson and Cushman, 1986; рис. 61.3). Этот эффект обратим: по мере разрушения инсулина белки —переносчики глюкозы возвращаются в свои внутриклеточные хранилища. Полагают, что нарушение данного процесса служит одним из патогенетических звеньев инсулинонезависимого сахарного диабета (Shepherd and Kahn, 1999).
Регуляция метаболизма глюкозы
Облегченная диффузия глюкозы в клетки по градиенту концентрации завершается фосфорилированием глюкозы. Образование глюко-зо-6-фосфата из глюкозы катализируется гексокиназой, четыре изофермента которой, подобно белкам — переносчикам глюкозы, распределены в разных тканях по-разному. Активность двух изоферментов гексокиназы регулируется инсулином. Гексокиназатипа IV, часто называемая глюкокиназой, имеет молекулярную массу 50 ООО и обнаруживается наряду с белком GLUT2 в гепатоцитах и β-клетках. Глюкокиназа кодируется одним геном, но в печени и островках поджелудочной железы при транскрипции этого гена используются разные промоторы и разные первые экзоны (Printz et al., 1993а). Транскрипция гена глюкокиназы в печени регулируется инсулином (Magnuson et al., 1989). Гексокиназа типа II имеет молекулярную массу 100 000; она присутствует в скелетных мышцах, миокарде и жировой ткани вместе с белком GLUT4. Инсулин регулирует транскрипцию и гена белка GLUT4, и гена гексокиназы типа II (Printz et al., 1993b).
Глюкозо-6-фосфат служит общим субстратом для двух метаболических путей. Во-первых, он включается в гликолиз — каскад ферментативных реакций, в результате которого образуется АТФ. Многие из реакций гликолиза усиливаются под действием инсулина: либо за счет регуляции транскрипции генов, кодирующих ферменты, либо за счет фосфорилирования или дефосфорилирования сериновых и треониновых остатков, ведущего к изменению активности ферментов. Во-вторых, глюкозо-6-фосфат может превращаться в глюкозо-1 -фосфат, из которого синтезируется гликоген. Инсулин стимулирует запасание гликогена, активируя гликогенсинтетазу (катализируемая этим ферментом реакция лимитирует скорость гликогенеза) и ингибируя фосфорилазу (катализируемая этим ферментом реакция лимитирует скорость гликогенолиза). Как и в случае гликолиза, эффекты инсулина опосредуются фосфорилированием и дефосфорилированием ферментов; это важнейший механизм действия данного гормона. Например, ацетил-КоА-карбоксилаза и АТФ-цитратлиаза активируются при фосфорилировании, а гликогенсинтетаза и пируватдегидрогеназа — при дефосфорилировании. Дефосфорилирование последних двух ферментов — результат активации инсулином фосфатаз. Подобным образом модифицируются и меняют свою активность десятки белков (Denton, 1986).
Регуляция транскрипции генов
В настоящее время нет сомнений в том. что важнейшим из эффектов инсулина является регуляция транскрипции тех или иных генов. Примером может служить ингибирование транскрипции гена фосфоенолпируваткарбоксикиназы (Granner et al., 1983). Этот эффект инсулина проливает свет на механизм торможения им глюконеогенеза (Sasaki et al., 1984) и объясняет, почему при инсулинорезистентности, характерной для инсулинонезависимого сахарного диабета, печень синтезирует избыток глюкозы (Granner and O’Brien, 1992). Известно более 100 генов, транскрипция которых регулируется инсулином (O’Brien and Granner, 1996), и этот список продолжает расти. Однако механизм, посредством которого инсулин влияет на транскрипцию, пока еще не расшифрован.
Рецептор инсулина
Инсулин оказывает свои эффекты, связываясь с мембранным рецептором. У млекопитающих эти рецепторы имеются почти на всех клетках — как на тех, что считаются классическими мишенями инсулина (гепатоцитах, миоцитах и липоцитах), так и на клетках крови, головного мозга и половых желез. Число рецепторов инсулина колеблется от 40 (у эритроцитов) до 300 ООО на клетку (у гепатоцитов и липоцитов).
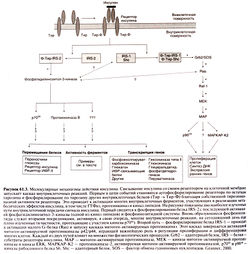
Рецептор инсулина представляет собой крупный трансмембранный гликопротеид, состоящий из двух а-субъединиц с молекулярной массой 135 ООО (по 719 или 731 аминокислотному остатку в зависимости от сплайсинга мРНК) и двух β-субъединиц с молекулярной массой 95 ООО (по 620 аминокислотных остатков). Субъединицы соединены дисульфидными связями в гетеротетрамер β-а-а-β (рис. 61.3) (Virkamaki et al., 1999). Обе субъединицы образуются из общего одноцепочечного предшественника, в составе которого аминокислотные последовательности а- и β-субъединиц разделены участком, состоящим из четырех основных аминокислотных остатков. Субъединицы рецептора наделены каждая своей функцией. Альфа-субъединицы расположены внеклеточно и содержат инсулинсвязываю-щий домен (см. выше), тогда как β-субъединицы образуют трансмембранный домен, обладающий тирозинкиназной активностью. После связывания инсулина с рецепторами происходит их агрегация и быстрая интернализация гормон-рецепторных комплексов. Поскольку двухвалентные антитела к рецептору инсулина, перекрестно связываясь с соседними рецепторами, имитируют эффект инсулина, а моновалентные антитела этим свойством не обладают, полагают, что агрегация рецепторов необходима для запуска каскада внутриклеточных реакций. После интернализации гормон-рецепторного комплекса рецептор инсулина либо разрушается, либо возвращается обратно в клеточную мембрану.
Фосфорилирование тирозиновых остатков и механизмы внутриклеточной передачи сигнала. Рецептор инсулина обладает собственной тирозинкиназной активностью (Virkamaki et al., 1999). Этим свойством обладают также рецепторы многих факторов роста, например эпидермального фактора роста, тромбоцитар-ного фактора роста и М-КСФ (Yarden and Ullrich, 1988). Знания о механизме передачи сигнала рецепторами с собственной тирозинкиназной активностью получены в основном при изучении белков, кодируемых онкогенами и вызывающих опухолевую трансформацию клеток, в частности тирозинкиназ семейства Src.
При связывании инсулина с а-субъединицами рецептора быстро происходит аутофосфорилирование тирозиновых остатков β-субъединиц. Эта аутокаталитическая реакция приводит к значительному усилению тирозинкиназной активности рецептора в отношении других белков. В нормальных клетках происходит также фосфорилирование сериновых и треониновых остатков рецептора инсулина, в основном под действием проте-инкиназ С и А. Эта последняя реакция ведет к подавлению тирозинкиназной активности рецептора (Cheatham and Kahn, 1995).
Тирозинкиназная активность рецептора необходима для проявления эффекта инсулина. Мутации, которые изменяют АТФ-связывающий центр или приводят к замене тирозиновых остатков, подвергающихся аутофосфорилированию, на другие, ведут к снижению собственной тирозинкиназной активности рецептора инсулина и ослаблению эффектов гормона (Ellis et al., 1986). Рецептор инсулина, не способный к аутофосфорилированию, полностью лишен активности.
Активированный рецептор инсулина запускает каскад внутриклеточных реакций, первой из которых является фосфорилирование четырех белков, называемых субстратами рецептора инсулина, — IRS-1, IRS-2, IRS-3 и IRS-4 (White et al., 1985). После фосфорилирования белок IRS-2 приобретает способность взаимодействовать с другими белками, которые содержат БШ-доме-ны (названные так вследствие гомологии с тирозинкиназой Src). Один из них — фосфатидилинозитол-3-киназа, гетеродимер, состоящий из каталитической субъединицы с молекулярной массой 110 000 (pi 10) и регуляторной субъединицы с молекулярной массой 85 000 (р85). Субъединица р85 содержит два БШ-домена, которые связываются с белком IRS-1. Фосфатидилинози-тол-3-киназа катализирует фосфорилирование фосфоинозити-дов в положении 3 инозитола, а продукты реакции участвуют во внутриклеточной передаче сигнала (фосфоинозитидная система). Фосфатидилинозитол-З-киназа активируется многими гормонами и факторами, которые стимулируют пролиферацию клеток; среди них — тромбоцитарный и эпидермальный факторы роста и ИЛ-4 (Virkamaki et al., 1999). Действие этого фермента на пролиферацию, по-видимому, опосредуется активацией проте-инкиназы В и, возможно, других киназ.
Одни из самых мощных митогенов — белки Ras, кодируемые одноименными онкогенами; они активируют каскад митоген-активируемых протеинкиназ. Об участии белков Ras в опосредовании эффектов инсулина задумались тогда, когда стало известно, что инсулин в числе прочих ферментов активирует и этот каскад (Avruch et al., 1994). Недавно выяснился и механизм этого участия, правда, не до конца. Активация рецепторов с собственной тирозинкиназной активностью, в том числе рецептора инсулина, приводит к взаимодействию еще одного содержащего SH2-домен белка — адаптерного белка Grb2 — с фосфорилированным белком IRS-1. Адагггерный белок Grb2 связывается с фактором обмена гуаниновых нуклеотидов SOS, и этот комплекс увеличивает сродство белков Ras к ГТФ. Активированный белок Ras взаимодействует с белком Raf-1 (серин-треониновой киназой), который, в свою очередь, активирует каскад митоген-активируемых протеинкиназ. Кроме того, активированный рецептор инсулина фосфорилирует содержащий БШ-домен адагггерный белок She, после чего тот связывается с белком Grb2. Это, по-видимому, приводит к усилению взаимодействия фактора обмена гуаниновых нуклеотидов SOS с клеточной мембраной, активации белков Ras и Raf-1 и каскада митоген-активируемых протеинкиназ. Механизм, посредством которого инсулин вызывает пролиферацию клеток, окончательно не установлен, но уже ясно, что в нем задействованы множественные, возможно даже избыточные, пути внутриклеточной передачи сигнала (Avruch et al., 1994).
Метаболическое действие инсулина, по-видимому, опосредуется белком IRS-2. Внутриклеточное перемещение белков — переносчиков глюкозы в мышцах и жировой ткани, ведущее к усилению транспорта глюкозы в клетки, — главный эффект инсулина. Перемещение белков-переносчиков блокируется ворг-маннином, ингибитором фосфатидилинозитол-3-киназы. Действие инсулина на транскрипцию генов ключевых ферментов углеводного обмена тоже блокируется вортманнином, поэтому не исключено, что он опосредуется белком IRS-2 и субстратами фосфатидилинозитол-3-киназы.